
Azot; hayatın devamı icin gerekli olan bir element. Havadaki azotun bitkilerde proteine donuşerek canlılara gecmesi sureci tam anlamıyla mucizevî…
 Azot, atmosferde en bol bulunan elementlerdendir. Canlı yaşamının devamı icin azota ihtiyac vardır. Azotun diğer adı; Latince “nitrum”, Yunanca “nitron” (doğal soda) kelimesinden tureyen “nitrojen”dir. Nitrojen, doğada bilinen en iyi soğutucudur. Azot dongusu, azotun, havadan canlıların DNA ’larına kadar suren uzun bir yolculuğudur. İnsan hayatı icin oksijen ve su kadar onemli olan azot, bitkilerde proteine donuşen nadide bir gazdır aynı zamanda... Azotun dunyasına yolculuk yapmak ister misiniz?
Azot, atmosferde en bol bulunan elementlerdendir. Canlı yaşamının devamı icin azota ihtiyac vardır. Azotun diğer adı; Latince “nitrum”, Yunanca “nitron” (doğal soda) kelimesinden tureyen “nitrojen”dir. Nitrojen, doğada bilinen en iyi soğutucudur. Azot dongusu, azotun, havadan canlıların DNA ’larına kadar suren uzun bir yolculuğudur. İnsan hayatı icin oksijen ve su kadar onemli olan azot, bitkilerde proteine donuşen nadide bir gazdır aynı zamanda... Azotun dunyasına yolculuk yapmak ister misiniz?
[h=4]Tarihce [/h]Azot, 1770 ’lerde keşfedilen bir gaz. Ancak orta cağlarda altını cozebilen azot bileşiği olan nitrik asit biliniyordu. O donemlerde azot bileşikleri zirai amaclarla gubre olarak, kimyasal hammaddelerde kullanılmış. Azotun bilimsel kayıtlara gecmesi ise 18. yuzyılda gercekleşiyor.
İskoc kimyager Daniel Rutherford, 1772 yılında Edinburrh Universitesi ’nde eğitim gorurken azotu izole eden ilk kimyacı olarak kayıtlara gecti. 1770 ’li yıllarda araştırmalar yapan bazı kimyagerler de (Schelle, Cavendish ve Priestley gibi) azotla ilgili bazı calışmalara imza attı. 1774 yılında Priestley, havanın yanmayan kısmının olduğunu tespit ederek, cıva oksidin ısıtılmasıyla azot elde etmiştir. Cavendish, azotun ozellikleri hakkında geniş incelemeler yapmıştır.
Rutherford, azotu keşfettiğinde “zararlı hava” ve “sabit hava” gibi isimler verdi. Gunumuzde de kullanılan adı ise, ilk olarak Fransız kimyacı Antoine-Laurent de Lavoisier verdi. Lavoisier, Yunanca “cansız” anlamındaki “azotos” kelimesinden turettiği “azote” sozcuğunu kullandı. Bu gaza “nitrojen” adını ise, Fransız kimyager Jean Antoine Chaptal, Yunanca “nitron” ve “gene” sozcuklerinin bileşimini kullanarak 1790 yılında verdi.
[h=3]Kimyasal Ozellikleri [/h]Azot, kimyasal simgesi “N” olan ametal bir elementtir. Serbest azot iki atomlu molekul halinde bulunduğu icin “N2” olarak simgelenir. Kimyasal reaksiyon denklemlerinde “N2” simgesi kullanılır. Atom numarası 7, atom ağırlığı 14,0067 ’dir. Kaynama noktası -196 derece, erime noktası -210 derecedir. Elektro negatiflik değeri 3,04 ’tur.
Azot, bircok elementle bileşik oluşturur. Onemli bileşikleri; siyanur, nitrik asit, amino asit, amonyaktır. Renksiz, tatsız, kokusuz ve atıl bir gaz olan azotun uclu kovalent bağı vardır. En onemli azot kaynağı havadır. Sıvı veya gaz halinde havadan distilasyon veya ters osmoz yontemleri ile elde edilir. Saf azot, sodyum asit ile amonyum dikromatın bozunması sonucu elde edilir. Aktif metaller, hava azotu ile nitrurleri oluşturur.
Azot elde edildiğinde iki adet karalı izotop ihtiva eder. Bu izotoplardan N14 yuzde 99,635, N15 ise yuzde 0,365 oranındadır. Dort adet de radyoaktif izotopu vardır. Bunlar; N12, N13, N16 ve N17 ’dir.
Molekuler azot; sıvı azotun ısıtılarak buharlaşması sonucu elde edilir. Bakteriler gibi canlı organizmalar tarafından faydalı bileşiklere donuşturulur ve atmosferde reaktif değildir. Elementer azot, tesiri az atıl bir gazdır. Yani normal şartlar altında diğer elementlerle reaksiyona girmez.
[h=4]Bunları Biliyor musunuz? [/h]
Azot, atmosferin yaklaşık yuzde 78 ’ini oluşturur. Atmosferde yuzde 21 oranında bulunan oksijenle karışım halindedir.
Butun canlı dokularda azot iceriği vardır. Canlılarda proteinler, vitaminler ve nukleik asitlerin yaklaşık yuzde 15 ’inde azot bulunur.
Hayvan dışkıları (ure veya urik asit) buyuk oranda azot icerir.
Ay, Saturn ve Titan gibi gezegenlerin atmosferinde buyuk oranda molekuler azot vardır. Mars ’taki azot oranı yuzde 3 civarındadır.
Guneş sistemi ve galakside en cok bulunan yedinci elementtir.
Atmosferdeki azot miktarı oksijenden dort kat daha fazladır. Ancak Dunya ’daki azot miktarı oksijenin onda biri kadardır. Bunun bir nedeni; gaz haldeki azotun Dunya ’nın katı haldeki merkezinde değil, gaz haldeki atmosferinde toplanmasıdır.
Guneş ışınları azot molekullerini parcalayamaz.
Sıvı azot, en iyi dondurucu olarak bilinir ve cilde temas ederse ani donmalara yol acar. Kısa surede -50 ve -170 derecede soğutma ve dondurma işlemi yapılabilir.
Proteinlerin oluşumu icin azota ihtiyac vardır. Canlılar da proteinsiz yaşayamaz. Yani yaşamın devamı icin azot gereklidir.
“Guldurucu gaz” olarak bilinen “azot protoksit”, anestetik ozelliği de bulunan bir gazdır. Doğumlarda ve diş hekimliğinde ağrı kesici olarak kullanılır.
Azot, insanların ve memeli hayvanların idrarında ure olarak bulunur.
Şimşek cakması sırasında oluşan azot oksitleri yağmur tarafından toprağa suruklenir.[h=3]Nerelerde Kullanılır? [/h]Endustriyel anlamdaki azot, doğalgaz ile amonyağa donuşturulerek gubre ve patlayıcı uretiminde kullanılır. Azot tuzu olan amonyum nitrat, gubrelerin onemli bir hammaddesidir. Potasyum nitrat gibi azot tuzları da barut yapımında kullanılır. Azot ayrıca, nitrik asit uretiminin başlangıc maddesidir. Havacılıkta da nitrojen ve bileşiklerinden faydalanılır. Ucak lastikleri yuksek sıcaklıklarda yanma riskine karşı nitrojen ile şişirilir.
Molekuler azotun kullanım alanı da cok geniştir. Paslanmaz celik uretimi, paketlenmiş gıdaların korunması icin kullanılabilen molekuler azot, sıvı patlayıcılarda ortu olarak ve elektronik bileşenlerin uretiminde kullanılabilmektedir.
Sıvı azot ise, super soğutma ozelliği sebebiyle gıda urunlerinin dondurulmasından biyolojik ve tıbbî numunelerin dondurularak saklanmasına kadar bircok alanda kullanılır. Bilgisayar donanımlarının soğutulması icin de nitrojenden faydalanılır. Sıvı azot, ani donma sağladığı icin gıdaların hucre yapısı bozulmaz. Bu sebeple gıdalardaki su kaybı onlenir, besin ve vitamin değerleri korunur. Buzdolaplarındaki buzluk bolumunde muhafaza edilen gıda urunleri bu sebeple uzun sure sonra bile tadı bozulmadan tuketilebilir. Bazı dayanıklı malzemeler de sıvı azot ile dondurularak kırılganlaşır ve geri donuşumu kolaylaşır.
Azotun bileşikleri ve tuzlarının kullanıldığı bazı urun ve alanları şoyle sayabiliriz: Fuzelerde oksitleyici madde olarak, fuze yakıtları, ucak ve kara aracları tekerleklerinin havası, hassas algılayıcılar, patlayıcılar, ilaclar, metalurji uygulamaları, elektronik cihazlar, hava ve uzay aracları, kimyasal urunlerin dondurulması, depo ve silo atmosferleri, gıda paketleme işlemleri, yuksek sıcaklık termometreleri…
[h=4]Azotlu Besinler [/h]Besinlerdeki azotlu bileşiklere protein veya proteid adı verilir. Azot, canlıların vucudu icin protein ve enerji kaynağıdır. Protein ve DNA ’nın onemli bir bileşeni olan azot genclerin hucre ve dokularının gelişimi, yaşlıların da dokularının tamir edilmesi icin gerekli bir elementtir. Yani oksijen ve karbondioksit nefes almak icin ne kadar onemliyse, buyumek icin de azot o kadar onemlidir. Kısacası, bu maddeler birbirleri ile bağlantılı olarak gorevlerini yerine getiriler.
Vucutta yakılan proteinlerden meydana gelen azot idrarla dışarı atılır. Vucudun protein kayıplarının olduğu ter atılması, dışkı, sac ve tırnak kesilmesi, kadınların regl durumları ve sut emzirmesi gibi durumlarda da vucut azot kaybeder. Bu sebeple emzikli kadınlar, cok ağır işlerde calışanlar ve surekli protein kaybedenlerin azotlu besinleri daha cok tuketmesi gerekir.
Azot bakımından zengin gıdalar arasında ilk sırayı yuzde 26 azot oranı ile mercimek alıyor. Mercimeği yuzde 25 ’lik oranla kuru fasulye ve sut tozu takip ediyor. Yuzde 25-15 arası azot iceren diğer gıdalar da şunlardır; kuru bakla, kaşar peyniri, badem, tavşan eti, tavuk eti, kuru bezelye, yaban ordeği eti, yağlı balık eti, sığır eti, yumurta sarısı, koyun eti, kuzu eti, nohut, ıstakoz, karaciğer, fındık, istiridye, ceviz, kaz eti, cikolata, kakao…
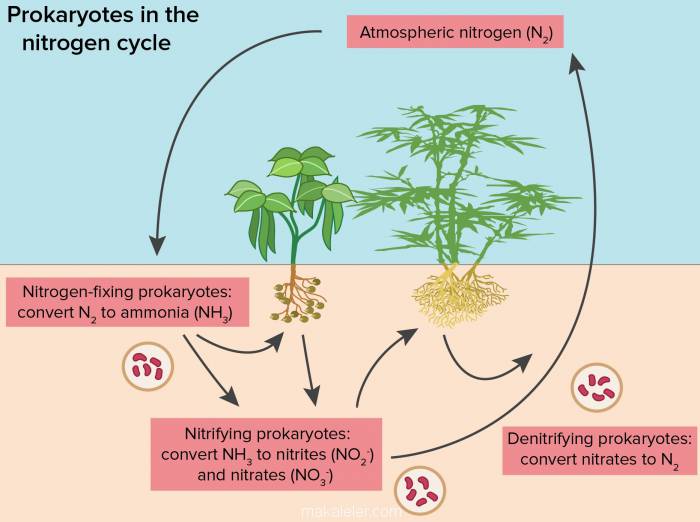
[h=3]Azot Dongusu Nedir? [/h]Azot, doğadaki yaşamsal dongulerden en onemlilerinden birini gercekleştirir. Yaşamın devamını sağlayan onemli bir doğa olayıdır. Protein oluşmasının temel bileşenlerinden biri olan elementtir. Canlı yaşamının yapı taşını oluşturan aminoaistler, proteinler, nukleik asitler, hormonların ve vitaminlerin iceriklerindeki azot yaşam icin temel maddelerdir. Azot dongusu; hava, madenler, hayvanlar ve bitkiler arasında azotun dağılımı olarak acıklanabilir. Azot bileşikleri, biyosferin ince bir tabakasında birbirine donuşerek donguyu tamamlar. Azotun tukenmemesi icin havadan toprağa, topraktan bitkilere, bitkilerden canlılara ve canlılardan tekrar havaya aktarılması gerekir. Peki, azot hangi evrelerden gecerek donguyu sağlıyor?
Canlılar ve bitkiler, havadaki molekul azotu (N2) sindiremezler. Bu sebeple bitkiler protein uretebilmek icin ihtiyac duydukları azotu topraktaki bileşiklerden alırlar. Başka bir deyişle; topraktaki inorganik azot bileşiklerini alan bitkiler, bazı elementlerle birlikte nukleik asitler ve bitkisel proteinler uretir.
Yağmur ve şimşekler sayesinde azotun donuşume katılması şoyle gercekleşir: Havadaki azot yağmur, şimşek ve yıldırımlar sayesinde nitrik aside donuşerek yeryuzune iner. Toprak tarafından emilen nitrik asit, kemosentetik bakteriler tarafından azot tuzlarına veya nitratlara donuşturulur. Azot tuzları da bitkiler tarafından emilerek proteine donuşur.
Biyolojik anlamda azot dongusu ise şoyle gercekleşir: Topraktaki bakteriler havadaki azotu doğrudan toprağa cekerek azot tuzlarına donuşturur. Suyla cozunen azot tuzları bitkiler tarafından emilir. Bitkilerin fotosentezi sonucunda emilen azot proteine donuşur. Hayvanlar bu bitkileri tuketerek proteinleri alır. İnsanlar da hayvansal gıdalardan ve doğrudan azotlu gıda tuketimi ile bu proteinleri alır. Bitkisel proteinler; hayvanlar ve insanlarda hayvansal proteine donuşur.
Havanın dışında bitkiler icin en onemli azot kaynağı, azot icerikli gubrelerdir. Baklagiller ve yoncalar elementer azot kullanır. Tarlalara ekilen yoncalar, toprağın azot bakımından zenginleşmesini sağlar.
Bu bilgiler ışığında azot dongusunu şoyle ozetleyebiliriz: Azotun doğadaki halinin ceşitli şekillerde bağlanarak bileşiğe donuştuğu olaylara “fiksasyon” adı verilir. Biyolojik, fizikokimyasal ve suni fiksasyon olarak uc şekilde gercekleşir.
Biyolojik fiksasyon; doğal yollarla bakteriler aracılığı ile inorganik formda gercekleşen dongudur.
Fizikokimyasal fiksasyon; yağmur, şimşek, yıldırım ve volkanik hareketler gibi olaylarla oluşan donuşume denir.
Suni fiksasyon ise, endustriyel olarak uretilen azot icerikli gubreler vasıtasıyla gercekleşir. Biyolojik ve suni fiksasyon, azot dongusunun başlıca etmenleridir.
 Azot, atmosferde en bol bulunan elementlerdendir. Canlı yaşamının devamı icin azota ihtiyac vardır. Azotun diğer adı; Latince “nitrum”, Yunanca “nitron” (doğal soda) kelimesinden tureyen “nitrojen”dir. Nitrojen, doğada bilinen en iyi soğutucudur. Azot dongusu, azotun, havadan canlıların DNA ’larına kadar suren uzun bir yolculuğudur. İnsan hayatı icin oksijen ve su kadar onemli olan azot, bitkilerde proteine donuşen nadide bir gazdır aynı zamanda... Azotun dunyasına yolculuk yapmak ister misiniz?
Azot, atmosferde en bol bulunan elementlerdendir. Canlı yaşamının devamı icin azota ihtiyac vardır. Azotun diğer adı; Latince “nitrum”, Yunanca “nitron” (doğal soda) kelimesinden tureyen “nitrojen”dir. Nitrojen, doğada bilinen en iyi soğutucudur. Azot dongusu, azotun, havadan canlıların DNA ’larına kadar suren uzun bir yolculuğudur. İnsan hayatı icin oksijen ve su kadar onemli olan azot, bitkilerde proteine donuşen nadide bir gazdır aynı zamanda... Azotun dunyasına yolculuk yapmak ister misiniz?[h=4]Tarihce [/h]Azot, 1770 ’lerde keşfedilen bir gaz. Ancak orta cağlarda altını cozebilen azot bileşiği olan nitrik asit biliniyordu. O donemlerde azot bileşikleri zirai amaclarla gubre olarak, kimyasal hammaddelerde kullanılmış. Azotun bilimsel kayıtlara gecmesi ise 18. yuzyılda gercekleşiyor.
İskoc kimyager Daniel Rutherford, 1772 yılında Edinburrh Universitesi ’nde eğitim gorurken azotu izole eden ilk kimyacı olarak kayıtlara gecti. 1770 ’li yıllarda araştırmalar yapan bazı kimyagerler de (Schelle, Cavendish ve Priestley gibi) azotla ilgili bazı calışmalara imza attı. 1774 yılında Priestley, havanın yanmayan kısmının olduğunu tespit ederek, cıva oksidin ısıtılmasıyla azot elde etmiştir. Cavendish, azotun ozellikleri hakkında geniş incelemeler yapmıştır.
Rutherford, azotu keşfettiğinde “zararlı hava” ve “sabit hava” gibi isimler verdi. Gunumuzde de kullanılan adı ise, ilk olarak Fransız kimyacı Antoine-Laurent de Lavoisier verdi. Lavoisier, Yunanca “cansız” anlamındaki “azotos” kelimesinden turettiği “azote” sozcuğunu kullandı. Bu gaza “nitrojen” adını ise, Fransız kimyager Jean Antoine Chaptal, Yunanca “nitron” ve “gene” sozcuklerinin bileşimini kullanarak 1790 yılında verdi.

[h=3]Kimyasal Ozellikleri [/h]Azot, kimyasal simgesi “N” olan ametal bir elementtir. Serbest azot iki atomlu molekul halinde bulunduğu icin “N2” olarak simgelenir. Kimyasal reaksiyon denklemlerinde “N2” simgesi kullanılır. Atom numarası 7, atom ağırlığı 14,0067 ’dir. Kaynama noktası -196 derece, erime noktası -210 derecedir. Elektro negatiflik değeri 3,04 ’tur.
Azot, bircok elementle bileşik oluşturur. Onemli bileşikleri; siyanur, nitrik asit, amino asit, amonyaktır. Renksiz, tatsız, kokusuz ve atıl bir gaz olan azotun uclu kovalent bağı vardır. En onemli azot kaynağı havadır. Sıvı veya gaz halinde havadan distilasyon veya ters osmoz yontemleri ile elde edilir. Saf azot, sodyum asit ile amonyum dikromatın bozunması sonucu elde edilir. Aktif metaller, hava azotu ile nitrurleri oluşturur.
Azot elde edildiğinde iki adet karalı izotop ihtiva eder. Bu izotoplardan N14 yuzde 99,635, N15 ise yuzde 0,365 oranındadır. Dort adet de radyoaktif izotopu vardır. Bunlar; N12, N13, N16 ve N17 ’dir.
Molekuler azot; sıvı azotun ısıtılarak buharlaşması sonucu elde edilir. Bakteriler gibi canlı organizmalar tarafından faydalı bileşiklere donuşturulur ve atmosferde reaktif değildir. Elementer azot, tesiri az atıl bir gazdır. Yani normal şartlar altında diğer elementlerle reaksiyona girmez.
[h=4]Bunları Biliyor musunuz? [/h]
Azot, atmosferin yaklaşık yuzde 78 ’ini oluşturur. Atmosferde yuzde 21 oranında bulunan oksijenle karışım halindedir.
Butun canlı dokularda azot iceriği vardır. Canlılarda proteinler, vitaminler ve nukleik asitlerin yaklaşık yuzde 15 ’inde azot bulunur.
Hayvan dışkıları (ure veya urik asit) buyuk oranda azot icerir.
Ay, Saturn ve Titan gibi gezegenlerin atmosferinde buyuk oranda molekuler azot vardır. Mars ’taki azot oranı yuzde 3 civarındadır.
Guneş sistemi ve galakside en cok bulunan yedinci elementtir.
Atmosferdeki azot miktarı oksijenden dort kat daha fazladır. Ancak Dunya ’daki azot miktarı oksijenin onda biri kadardır. Bunun bir nedeni; gaz haldeki azotun Dunya ’nın katı haldeki merkezinde değil, gaz haldeki atmosferinde toplanmasıdır.
Guneş ışınları azot molekullerini parcalayamaz.
Sıvı azot, en iyi dondurucu olarak bilinir ve cilde temas ederse ani donmalara yol acar. Kısa surede -50 ve -170 derecede soğutma ve dondurma işlemi yapılabilir.
Proteinlerin oluşumu icin azota ihtiyac vardır. Canlılar da proteinsiz yaşayamaz. Yani yaşamın devamı icin azot gereklidir.
“Guldurucu gaz” olarak bilinen “azot protoksit”, anestetik ozelliği de bulunan bir gazdır. Doğumlarda ve diş hekimliğinde ağrı kesici olarak kullanılır.
Azot, insanların ve memeli hayvanların idrarında ure olarak bulunur.
Şimşek cakması sırasında oluşan azot oksitleri yağmur tarafından toprağa suruklenir.[h=3]Nerelerde Kullanılır? [/h]Endustriyel anlamdaki azot, doğalgaz ile amonyağa donuşturulerek gubre ve patlayıcı uretiminde kullanılır. Azot tuzu olan amonyum nitrat, gubrelerin onemli bir hammaddesidir. Potasyum nitrat gibi azot tuzları da barut yapımında kullanılır. Azot ayrıca, nitrik asit uretiminin başlangıc maddesidir. Havacılıkta da nitrojen ve bileşiklerinden faydalanılır. Ucak lastikleri yuksek sıcaklıklarda yanma riskine karşı nitrojen ile şişirilir.
Molekuler azotun kullanım alanı da cok geniştir. Paslanmaz celik uretimi, paketlenmiş gıdaların korunması icin kullanılabilen molekuler azot, sıvı patlayıcılarda ortu olarak ve elektronik bileşenlerin uretiminde kullanılabilmektedir.
Sıvı azot ise, super soğutma ozelliği sebebiyle gıda urunlerinin dondurulmasından biyolojik ve tıbbî numunelerin dondurularak saklanmasına kadar bircok alanda kullanılır. Bilgisayar donanımlarının soğutulması icin de nitrojenden faydalanılır. Sıvı azot, ani donma sağladığı icin gıdaların hucre yapısı bozulmaz. Bu sebeple gıdalardaki su kaybı onlenir, besin ve vitamin değerleri korunur. Buzdolaplarındaki buzluk bolumunde muhafaza edilen gıda urunleri bu sebeple uzun sure sonra bile tadı bozulmadan tuketilebilir. Bazı dayanıklı malzemeler de sıvı azot ile dondurularak kırılganlaşır ve geri donuşumu kolaylaşır.
Azotun bileşikleri ve tuzlarının kullanıldığı bazı urun ve alanları şoyle sayabiliriz: Fuzelerde oksitleyici madde olarak, fuze yakıtları, ucak ve kara aracları tekerleklerinin havası, hassas algılayıcılar, patlayıcılar, ilaclar, metalurji uygulamaları, elektronik cihazlar, hava ve uzay aracları, kimyasal urunlerin dondurulması, depo ve silo atmosferleri, gıda paketleme işlemleri, yuksek sıcaklık termometreleri…
[h=4]Azotlu Besinler [/h]Besinlerdeki azotlu bileşiklere protein veya proteid adı verilir. Azot, canlıların vucudu icin protein ve enerji kaynağıdır. Protein ve DNA ’nın onemli bir bileşeni olan azot genclerin hucre ve dokularının gelişimi, yaşlıların da dokularının tamir edilmesi icin gerekli bir elementtir. Yani oksijen ve karbondioksit nefes almak icin ne kadar onemliyse, buyumek icin de azot o kadar onemlidir. Kısacası, bu maddeler birbirleri ile bağlantılı olarak gorevlerini yerine getiriler.
Vucutta yakılan proteinlerden meydana gelen azot idrarla dışarı atılır. Vucudun protein kayıplarının olduğu ter atılması, dışkı, sac ve tırnak kesilmesi, kadınların regl durumları ve sut emzirmesi gibi durumlarda da vucut azot kaybeder. Bu sebeple emzikli kadınlar, cok ağır işlerde calışanlar ve surekli protein kaybedenlerin azotlu besinleri daha cok tuketmesi gerekir.
Azot bakımından zengin gıdalar arasında ilk sırayı yuzde 26 azot oranı ile mercimek alıyor. Mercimeği yuzde 25 ’lik oranla kuru fasulye ve sut tozu takip ediyor. Yuzde 25-15 arası azot iceren diğer gıdalar da şunlardır; kuru bakla, kaşar peyniri, badem, tavşan eti, tavuk eti, kuru bezelye, yaban ordeği eti, yağlı balık eti, sığır eti, yumurta sarısı, koyun eti, kuzu eti, nohut, ıstakoz, karaciğer, fındık, istiridye, ceviz, kaz eti, cikolata, kakao…

[h=3]Azot Dongusu Nedir? [/h]Azot, doğadaki yaşamsal dongulerden en onemlilerinden birini gercekleştirir. Yaşamın devamını sağlayan onemli bir doğa olayıdır. Protein oluşmasının temel bileşenlerinden biri olan elementtir. Canlı yaşamının yapı taşını oluşturan aminoaistler, proteinler, nukleik asitler, hormonların ve vitaminlerin iceriklerindeki azot yaşam icin temel maddelerdir. Azot dongusu; hava, madenler, hayvanlar ve bitkiler arasında azotun dağılımı olarak acıklanabilir. Azot bileşikleri, biyosferin ince bir tabakasında birbirine donuşerek donguyu tamamlar. Azotun tukenmemesi icin havadan toprağa, topraktan bitkilere, bitkilerden canlılara ve canlılardan tekrar havaya aktarılması gerekir. Peki, azot hangi evrelerden gecerek donguyu sağlıyor?
Canlılar ve bitkiler, havadaki molekul azotu (N2) sindiremezler. Bu sebeple bitkiler protein uretebilmek icin ihtiyac duydukları azotu topraktaki bileşiklerden alırlar. Başka bir deyişle; topraktaki inorganik azot bileşiklerini alan bitkiler, bazı elementlerle birlikte nukleik asitler ve bitkisel proteinler uretir.
Yağmur ve şimşekler sayesinde azotun donuşume katılması şoyle gercekleşir: Havadaki azot yağmur, şimşek ve yıldırımlar sayesinde nitrik aside donuşerek yeryuzune iner. Toprak tarafından emilen nitrik asit, kemosentetik bakteriler tarafından azot tuzlarına veya nitratlara donuşturulur. Azot tuzları da bitkiler tarafından emilerek proteine donuşur.
Biyolojik anlamda azot dongusu ise şoyle gercekleşir: Topraktaki bakteriler havadaki azotu doğrudan toprağa cekerek azot tuzlarına donuşturur. Suyla cozunen azot tuzları bitkiler tarafından emilir. Bitkilerin fotosentezi sonucunda emilen azot proteine donuşur. Hayvanlar bu bitkileri tuketerek proteinleri alır. İnsanlar da hayvansal gıdalardan ve doğrudan azotlu gıda tuketimi ile bu proteinleri alır. Bitkisel proteinler; hayvanlar ve insanlarda hayvansal proteine donuşur.
Havanın dışında bitkiler icin en onemli azot kaynağı, azot icerikli gubrelerdir. Baklagiller ve yoncalar elementer azot kullanır. Tarlalara ekilen yoncalar, toprağın azot bakımından zenginleşmesini sağlar.
Bu bilgiler ışığında azot dongusunu şoyle ozetleyebiliriz: Azotun doğadaki halinin ceşitli şekillerde bağlanarak bileşiğe donuştuğu olaylara “fiksasyon” adı verilir. Biyolojik, fizikokimyasal ve suni fiksasyon olarak uc şekilde gercekleşir.
Biyolojik fiksasyon; doğal yollarla bakteriler aracılığı ile inorganik formda gercekleşen dongudur.
Fizikokimyasal fiksasyon; yağmur, şimşek, yıldırım ve volkanik hareketler gibi olaylarla oluşan donuşume denir.
Suni fiksasyon ise, endustriyel olarak uretilen azot icerikli gubreler vasıtasıyla gercekleşir. Biyolojik ve suni fiksasyon, azot dongusunun başlıca etmenleridir.